El agua en el organismo constituye alrededor del 60% del peso de los hombres y el 55% en las mujeres, de ese porcentaje el 55% se ubica de forma intracelular y aproximadamente el 45% se encuentra de forma extracelular. Este último se puede encontrar en el líquido intersticial, el plasma y fluidos transcelular ubicados en cavidades. Los fluidos ubicados en cavidades corporales son diversos y tienen variaciones tanto físicas, químicas y celulares por lo que los parámetros estudiados en cada uno de ellos son distintos, estos fluidos son útiles para evaluar trastornos inflamatorios, infecciosos, malignos o hemorrágicos que comprometan las membranas o cavidades dónde se ubican. Existen distintos tipos, entre ellos:
- Líquido cefalorraquídeo
- Líquido de las membranas serosas (pericárdico, peritoneal y pleural)
- Líquido sinovial
- Semen
- Secreciones o contenido vaginal
- Secreciones bronquiales
- Líquido amniótico
- Incluso la orina y las heces se consideran fluidos.
GENERALIDADES DEL PROCESAMIENTO DE LOS LÍQUIDOS
Volumen
Los líquidos corporales fisiológicamente son reducidos en volumen, en el caso de los serosos bajo condiciones patológicas pueden elevar su volumen de mililitros a litros.
Color y apariencia
El color y la apariencia puede variar según la cavidad, el líquido cefalorraquídeo y sinovial normalmente son incoloros y transparentes, mientras que los líquidos de las serosas son ligeramente amarillentos y transparentes. Tanto el color como su apariencia varían por cuestiones patológicas y se abordaran en cada líquido.
Conteo celular
Habitualmente se hacen conteos de los leucocitos y en raras ocasiones de los eritrocitos (estos últimos carecen de significancia clínica en la mayoría de los líquidos), se realizan frecuentemente de forma manual en cámaras de Neubauer, no es aconsejable utilizar equipos automatizados ya que por la naturaleza de sus lisantes pueden afectar las células, salvo que el equipo tenga la opción de conteos en líquidos.
Dependiendo las características del líquido puede ser requeridas diluciones (tabla 1). Las cuales pueden ser realizadas con solución salina fisiológica, si se desea eliminar los eritrocitos para que no interfieran en el conteo se utiliza solución salina hipotónica o ácido acético al 3%, este último no se debe ocupar en líquido sinovial ya que la interacción con el ácido hialurónico forma un pseudocoagulo.
Tabla 1. Diluciones utilizadas en los líquidos corporales basadas en la apariencia.

*Usar diluyente para lisar eritrocitos
Dependiendo el tipo celular será los cuadrados que se deben contar, para los leucocitos se utilizan los cuatro cuadrados de las esquinas o los cuatro y el del centro (Figura 1). Para los eritrocitos se realiza el conteo en los cuatro cuadrantes medianos de las esquinas y el de en medio (cuadrados rojos).
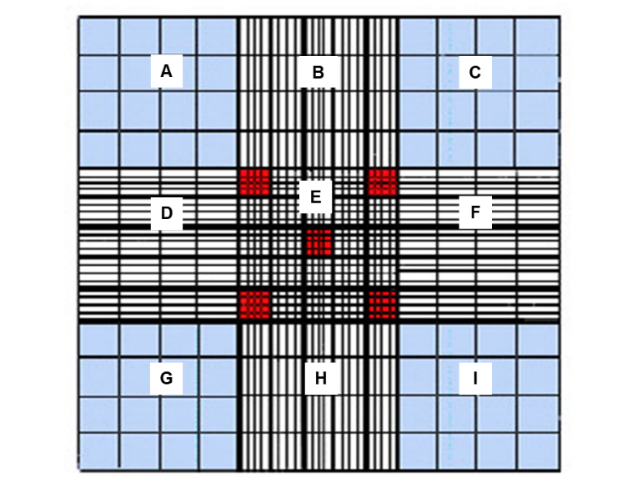
Figura 1. Retícula de la cámara de Neubauer.
Tanto para el conteo de leucocitos y eritrocitos se puede tomar en cuenta la siguiente fórmula para determinar la cantidad de células por µL o mm3:
# células x FD x 10/A
Dónde # células es la cantidad de células contadas, FD es el factor de dilución y A el tamaño del área contada en mm2. Los cuadrados grandes (A, C, E, G, I) miden cada uno 1 mm2, mientras que los cuadrados medianos de la cuadricula del centro (rojos) miden 0.04 mm2. Es importante tener en cuenta que la lectura debe ser doble y que los resultados de las lecturas no deben de sobrepasar el 20% de diferencia, si lo rebasan la cuenta se debe repetir.
Ejemplo 1: muestra de líquido cefalorraquídeo transparente, se leyó en cámara sin diluir y se contaron 10 leucocitos en los cuatro cuadrantes de las esquinas (A, C, G e I), ¿Cuántos leucocitos por µL serían?
- Número de células contadas= 10
- Factor de dilución= 1
- Área contada en mm2= si cada cuadrado mide 1 mm2 x 4= 4 mm2
Número de leucocitos/µL= 10 x 1 x 10/4 = 25 leucocitos/µL
Ejemplo 2: muestra de líquido pleural turbia se realizó conteo usando una dilución 1:20 con solución salina fisiológica, el conteo de los cuatro cuadrantes grandes de las esquinas arrojo 25 leucocitos.
- Número de células contadas= 25
- Factor de dilución= 20
- Área contada en mm2= si cada cuadrado mide 1 mm2 x 4= 4 mm2
Número de leucocitos/µL= 10 x 20 x 10/4 = 500 leucocitos/µL.
Citología de los líquidos biológicos
En este parámetro se evalúan tanto la cuenta diferencial de los leucocitos y la celularidad benigna o neoplásica, cabe señalar que es necesario realizar las preparaciones en portaobjetos lo más rápido posible para evitar la degradación de las células. Para este análisis es necesario realizar una preparación en portaobjetos, se debe evitar realizar un extendido en cuña (como las preparaciones de sangre) ya que la celularidad se puede perder al extenderse en una gran superficie y además la preservación de las células es baja. Existen distintas técnicas para la obtención de sedimento y se prefiere la citocentrifugación, filtración o en su defecto se puede realizar una centrifugación a bajas gravedades por un tiempo prolongado. En cuanto a la tinción habitualmente se utiliza la técnica de Wight, Wright-Giemsa o Papanicolaou.
Bibliografía consultada
Strasinger, S. K. and Schaub Di Lorenzo, M. (2014) Urinalysis and Body Fluids. 6th edn. United States of America: F. A. Davis Company.
Mundt, L. a. and Shanahan, K. (2011) Graff’s Textbook of Routine Urinalysis and Body Fluids. 2nd edn. China: Lippincott Williams and Wilkins.