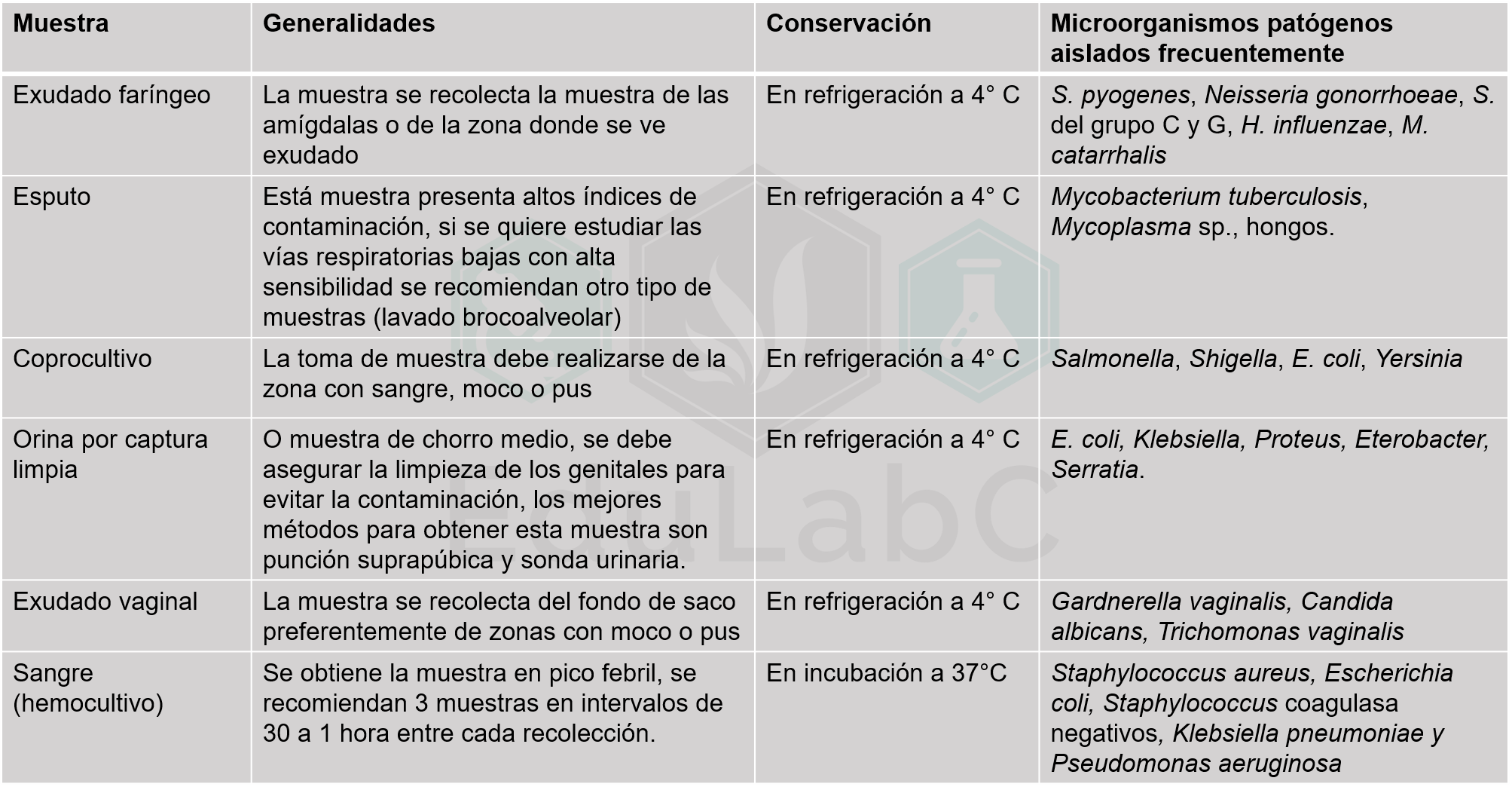
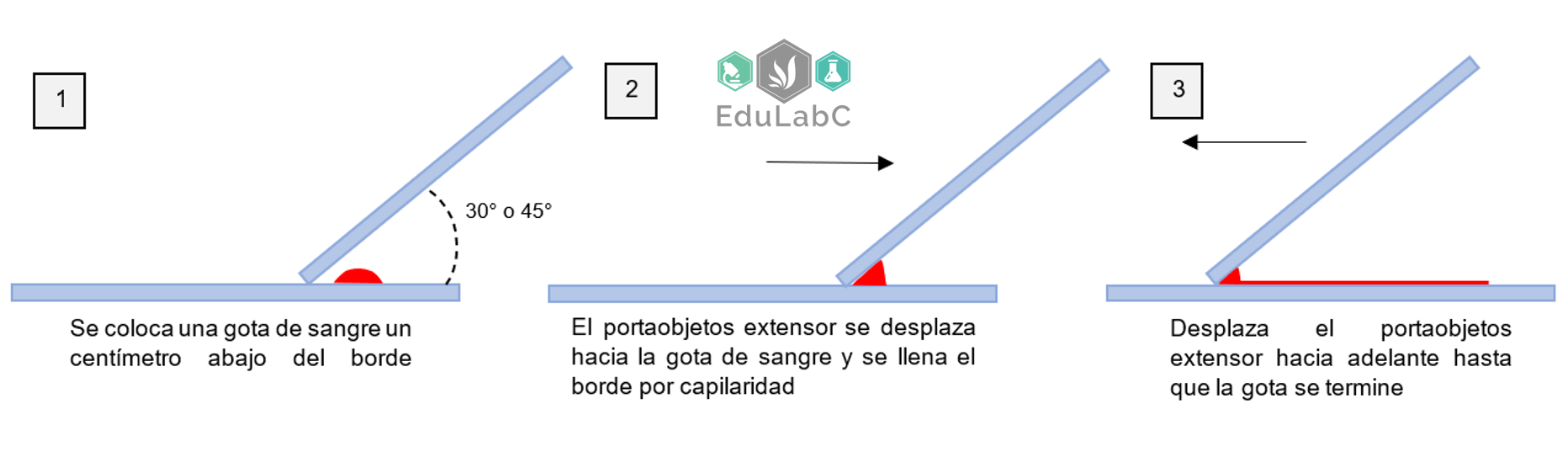
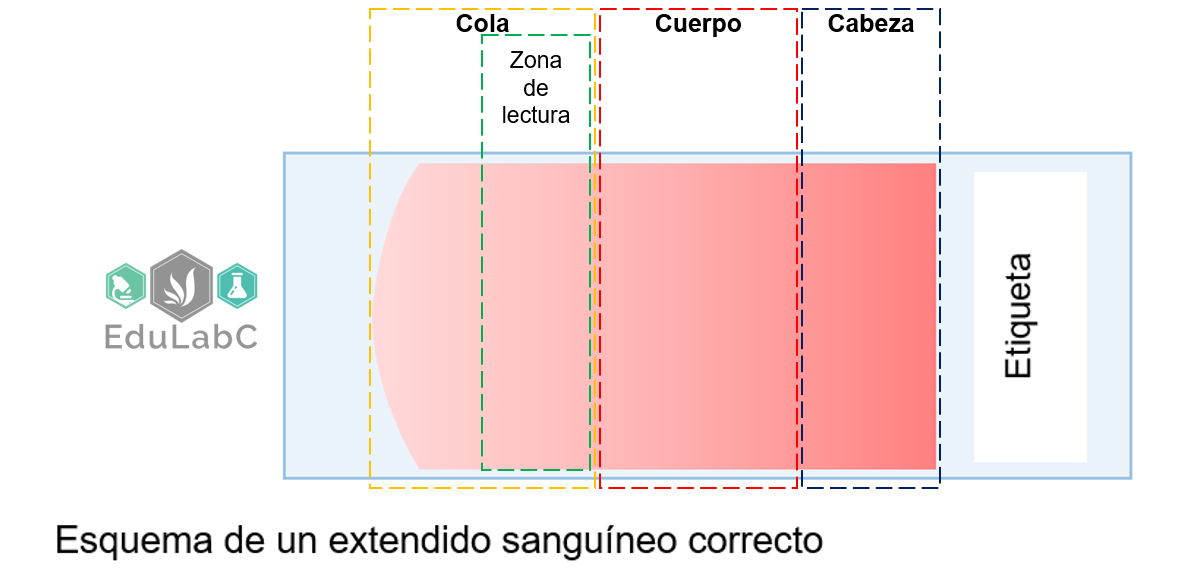
CLASIFICACIÓN DE LAS ANEMIAS
La anemia se define como la disminución de la hemoglobina según los valores de referencia ajustados a la edad, sexo y altitud sobre el nivel del mar. Es importante señalar que ni el hematocrito o el número de eritrocitos se deben utilizar para definir a este síndrome, ya que existen entidades en que el número se encuentra normal o elevado (talasemias) pero la hemoglobina baja. La anemia provoca hipoxia tisular desencadenando mecanismos de compensación que juntos son los que provocan los signos y síntomas característicos (palidez, fatiga, disnea, etc.). Como se mencionó la anemia es un síndrome y no una enfermedad, por lo que es importante establecer la etiología de la misma ya que el tratamiento debe ser dirigido a tratar el padecimiento y no solo reestablecer los niveles de hemoglobina, por esta razón es importante poder clasificar las mismas para encontrar la etiología.
Clasificación
Las anemias se pueden clasificar desde tres puntos en vista en:
- Patogénica: basada en el conteo de reticulocitos
- Morfológica: en la que se toman en cuenta los índices de Wintrobe
- Presentación clínica: según el tiempo que tiene instalada la anemia
Las anemias según la presentación clínica se pueden clasificar en agudas y crónicas, mientras que la patogénica se basa en el número de reticulocitos y se dividen en regenerativas e hiporegenerativas y por último la clasificación morfológica en la que se clasifican las anemias en microcíticas, normocíticas y macrocíticas de todas la última es la más importante y ampliamente utilizada, aunque usando la clasificación morfológica y patogénica podemos obtener datos muy importantes respecto al posible origen de la anemia.
Clasificación patogénica o fisiopatológica
El conteo de reticulocitos es un parámetro útil ya que me indica como responde la medula ósea a la anemia. Una disminución de los eritrocitos estimula la eritropoyesis a través del aumento de la eritropoyetina, por lo tanto, existe una relación inversa entre la disminución de la hemoglobina y el aumento de los reticulocitos (anemia regenerativa), sin embargo, cuando la hemoglobina disminuye y la medula ósea no tiene capacidad regenerativa por lo que el aumento de reticulocitos no sucede incluso a pesar del aumento de la eritropoyetina (anemias hiporegenerativas)
Esta clasificación es importante principalmente en las anemias normocíticas normocrómicas, cuando la anemia es regenerativa se vincula a sangrados o anemias hemolíticas, mientras que en las hiporegenerativas se puede deber a un defecto en la producción de eritrocitos por alteraciones en la célula tronco hematopoyética (anemia aplásica) o en los progenitores eritroides (aplasia de serie roja) y también se puede deber a disminución en la producción de eritropoyetina que es la causa más frecuente (anemia secundaria a la enfermedad renal).
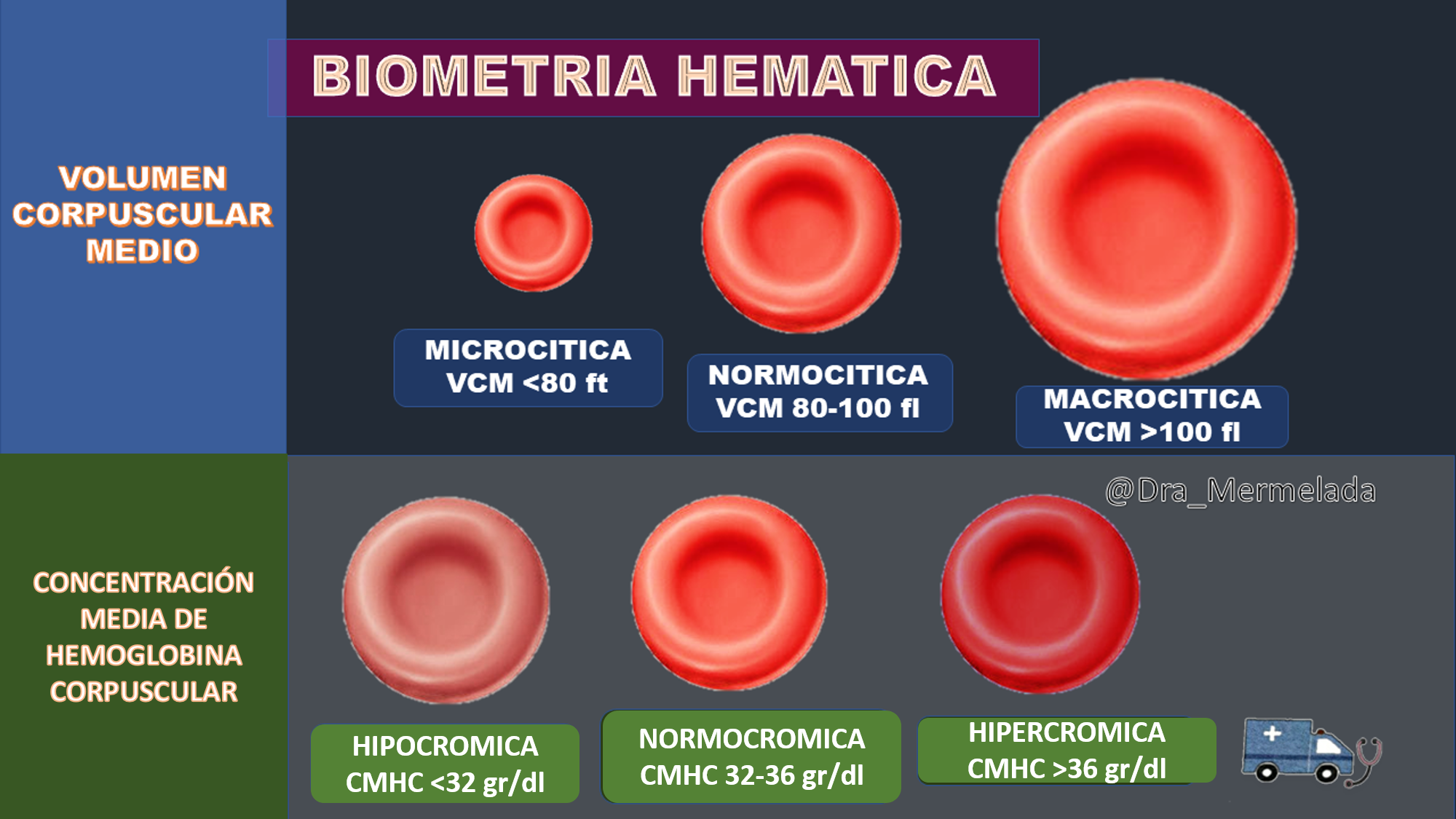
Clasificación morfológica
La clasificación patológica es importante para entender los mecanismos implicados en la génesis de la anemia, sin embargo, la clasificación morfológica es la más útil y arroja información relevante a partir de la biometría hemática. Fueron descritos por Wintrobe en 1932 por lo que se conocen como índices eritrocitarios de Wintrobe, estos definen el volumen de los eritrocitos y el contenido de hemoglobina de los mismos, es así que, para clasificar la anemia se usan dos aspectos, el volumen del eritrocito y su contenido de hemoglobina, para esto se utiliza el volumen corpuscular medio y la concentración media de hemoglobina corpuscular, existe una confusión respecto a utilizar la CMHC y la HCM para definir la cromía del eritrocito, la HCM establece la cantidad de hemoglobina por cada eritrocito, pero la CMHC indica la concentración de hemoglobina respecto a su volumen, es por esto, que el equipo puede indicar hipercrómica si usamos la HCM pero al observar el extendido no se observa tal condición lo mismo sucede con algunas anemias microcíticas, la HCM pueden indicar hipocromía pero en el extendido no observamos eso, ya que la hemoglobina esta baja pero es la adecuada para el volumen del eritrocito (microcítico). Explicado lo anterior, la clasificación se basa del VMC y la CMHC y es así que se generan 3 tipos de anemias, las microcíticas hipocrómicas (VCM <83 fl y CMHC <32 gr/dl), normocíticas normocrómicas (VCM 83-100 fl y CMHC 32-36 gr/dl) y las macrocíticas (VCM >100 fl). Dentro de cada grupo de anemias existen probables causas que se deben de descartar, por ejemplo:
- Anemias microcíticas hipocrómicas: anemia por deficiencia de hierro, anemia por deficiencia de hierro relativa (de los padecimientos crónicos), talasemia y anemia sideroblástica.
- Anemias normocíticas normocrómicas: anemia secundaria a sangrados, anemias hemolíticas hereditarias y adquiridas, anemias secundarias a enfermedad renal o hipotiroidismo, anemias aplásicas.
- Anemia macrocítica: anemia megaloblástica, anemia perniciosa, anemia macrocítica no megaloblástica.
Cabe recalcar que dependiendo cuanto tiempo tiene instalada la anemia, el tipo de paciente y la etiología, por ejemplo, en pacientes con anemias hemolíticas puede existir una falsa macrocitosis generada por los reticulocitos, en anemias por deficiencia de hierro puede no haber anemia, pero si microcitosis con normocromía, es por eso que las anemias se deben confirmar con estudios complementarios y posteriormente investigar la causa de dicho padecimiento.
Otro dato a tomar en cuenta de la clasificación morfológica es que a partir de valores de VCM y CMHC obtenidos por cálculos existe un amplio margen de error, por lo que esto puede crear estudios innecesarios en el paciente.
Valores de referencia
En la siguiente tabla colocamos los valores de referencia de los reticulocitos y los índices eritrocitarios.

Bibliografía consultada:
Moreno Chulilla, J. A., Romero Colás, M. S., & Gutiérrez Martín, M. (2009). Classification of anemia for gastroenterologists. World journal of gastroenterology, 15(37), 4627–4637.
Campuzano MG. Del hemograma manual al hemograma de cuarta generación. Medicina & Laboratorio. 2007;13(11-12):511-550.