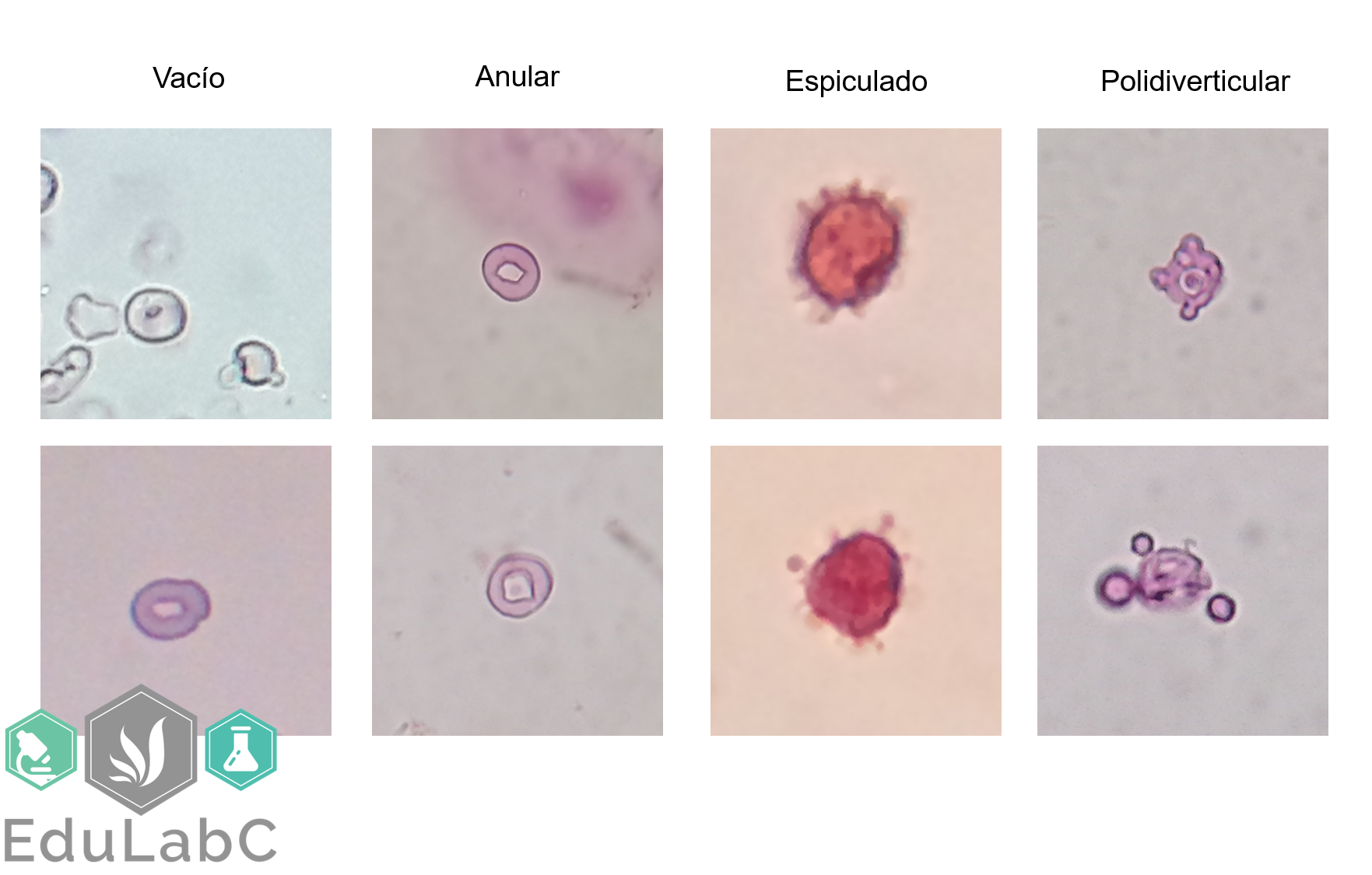
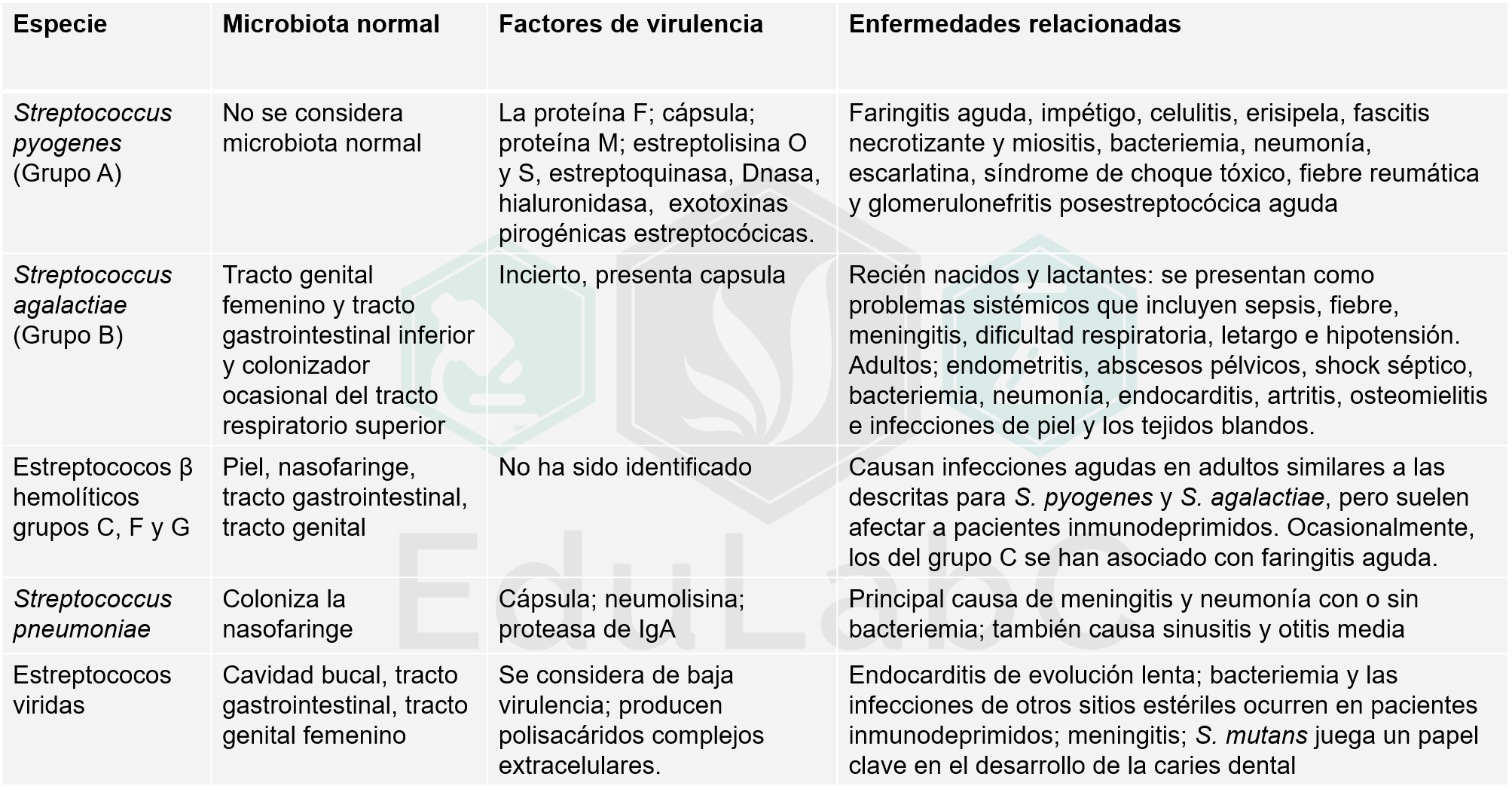
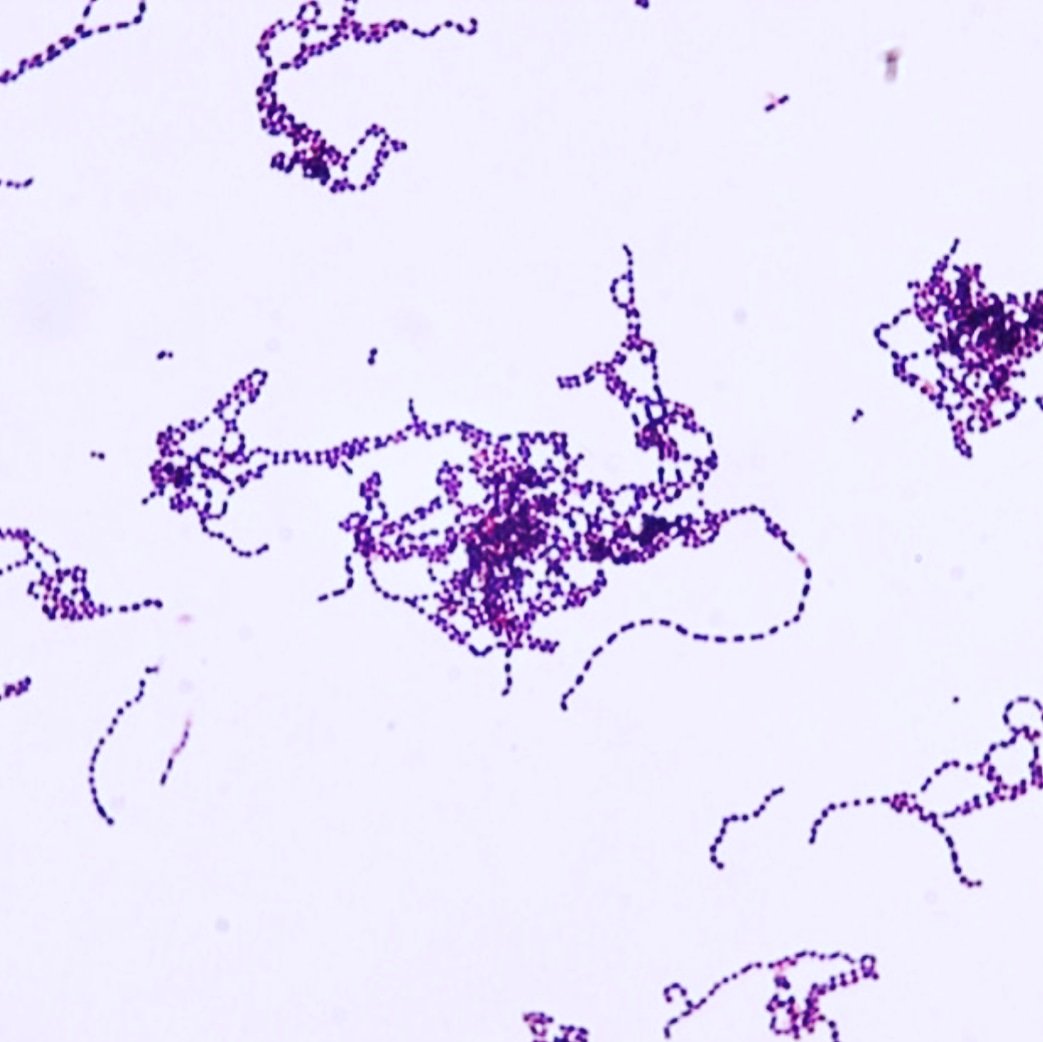
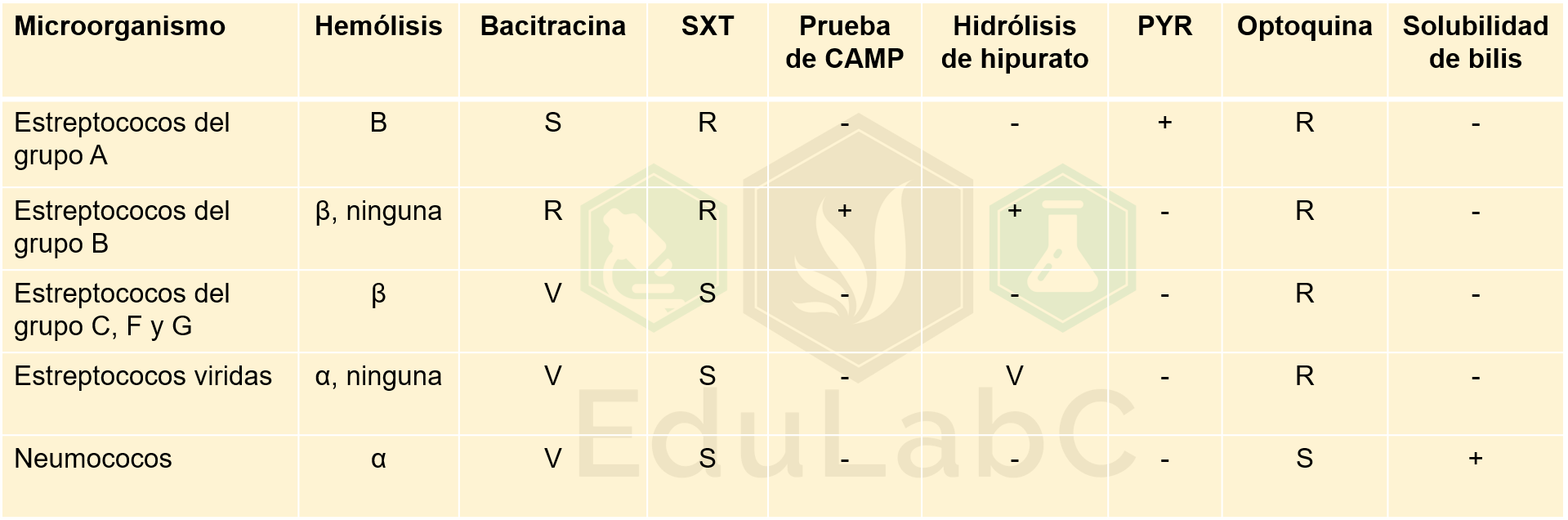
COVID-19: todo lo que hay que saber
Introducción
A finales del 2019 aparece un cuadro de neumonía de origen desconocido en un grupo de pacientes, posteriormente se notificó que esta neumonía era causada por un nuevo coronavirus denominado COVID-19 que después el Comité Internacional de Nomenclatura de Virus lo denomino SARS-CoV-2. La presencia de COVID-19 en el organismo se manifiesta con varios síntomas, que pueden ser totalmente asintomáticos hasta enfermedad grave y causar la muerte.
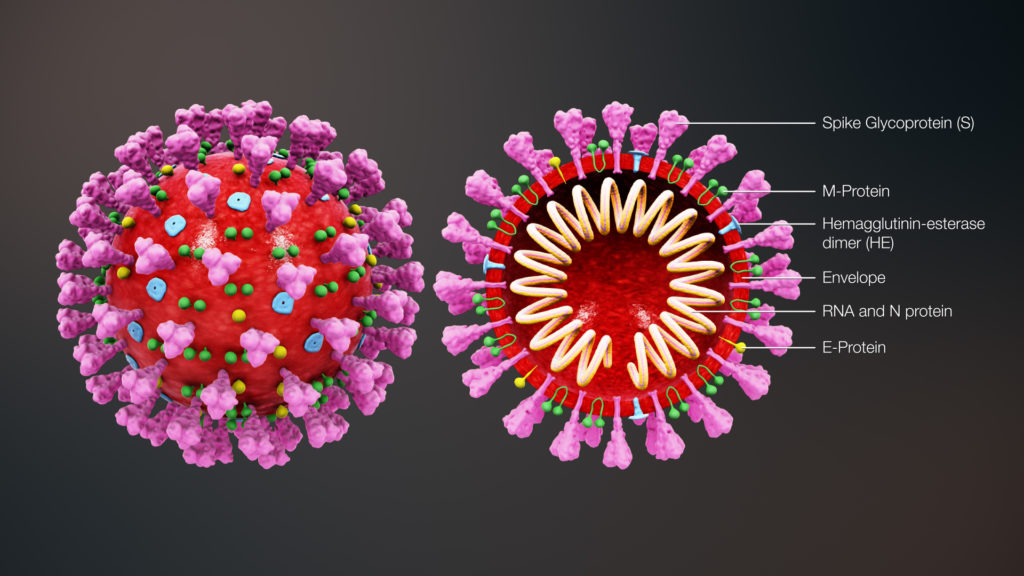
Virología del coronavirus
Pertenece al género beta-CoVs y su nombre se debe a su apariencia en el microscopio electrónico, ya que se observan estructuras que irradia a manera de una corona, estas estructuras denominadas peplómeros pertenecen a una glicoproteína llamada “pico (S)”. La glicoproteína S, M y la proteína pequeña (E) se encuentran en la envoltura del virus. La glicoproteína S es un antígeno que tiene la función de unirse a los receptores celulares y realizar la fusión. Mientras que la glicoproteína M tiene la función de formar la envoltura y ensamblaje del virión. Por otro lado, el virus tiene un genoma de ARN monocatenario positivo con aproximadamente 26 – 32 Kpb, esta metilado en el extremo 5’ y tiene una cola de poli A en 3’. El ARN está asociada a la cápside (N) por la fosfoproteína básica.
Rutas de transmisión
Las rutas de transmisión pueden ser directos o indirectos, en el primer caso corresponde a la inhalación directa de gotitas liberadas al estornudar o toser y la trasmisión por contacto con la mucosa oral, nasal y ocular. Mientras que los mecanismos indirectos se refieren a la interacción con fómites o superficies contaminadas.
Manifestaciones clínicas
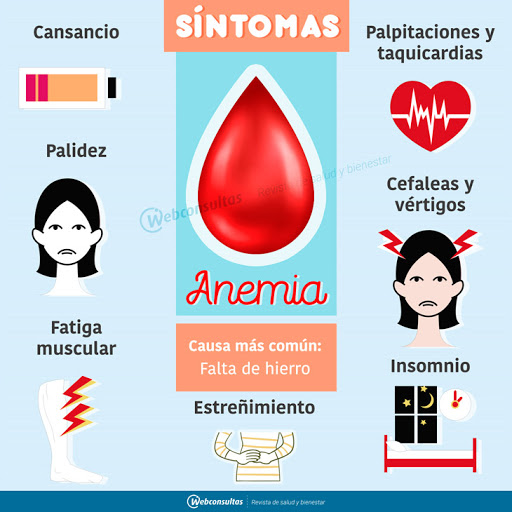
Las manifestaciones clínicas son inespecíficas, los síntomas comunes son fiebre, tos no productiva, mialgia y cansancio extremo. Otros síntomas menos comunes son diarrea, náuseas, dolor de cabeza, vómitos y dolor abdominal. Las personas que requieren mayores cuidados son aquellas que presentan comorbilidades como diabetes, hipertensión, enfermedad cardiovascular o trastornos neurológicos.
Patogenia
Hasta el momento no se ha dilucidado exactamente el proceso de patogénesis del SARS-CoV-2, pero todo parece apuntar a la tormenta de citocinas y a los efectos deletéreos de la angiotensina II.
Para que el virus entre a la célula la glicoproteína S se una a la enzima transformadora de angiotensina 2 (ACE2) en la célula diana. Esta unión ocasiona la internalización del complejo virus-ACE2, lo que lleva a la regulación a la baja de esta enzima y por lo tanto su disminución en las membranas celulares. Esto conlleva al aumento de la activación del eje angiotensina II (Ang II)-receptor de angiotensina tipo I (AT1R) y esta desregulación ocasiona:
- La activación del sistema renina angiotensina aldosterona (RAAS) induce inflamación a través del receptor AT1R en riñón y vasculatura.
- La activación de RAAS induce la secreción de enzimas profibróticas como el factor de crecimiento transformante beta.
- El aumento de Ang II y AT1R se acompaña de una respuesta proinflamatoria a través de la activación de la cascada de complemento.
- Hiperactividad de NK-kB que conduce a una mayor producción de IL-6, TNFα, IL-1B e IL-10 y por lo tanto contribuye a la tormenta de citocinas.
- Después de la activación de AT1R, Ang II regula las proteínas quinasas activadas por mitógenos (MAPK), que participan en la liberación de citocinas como IL-1, IL-10, IL-12. y TNFα.
Además de los mecanismos antes postulados, también se ha sugerido la activación del eje ACE2/DANK/bradicina B1 que conduce a un aumento de la liberación de citocinas lo que explicaría el evento de “tormenta de citocinas”. Si se quiere profundizar se recomienda consultar los artículos mostrados en la bibliografía.
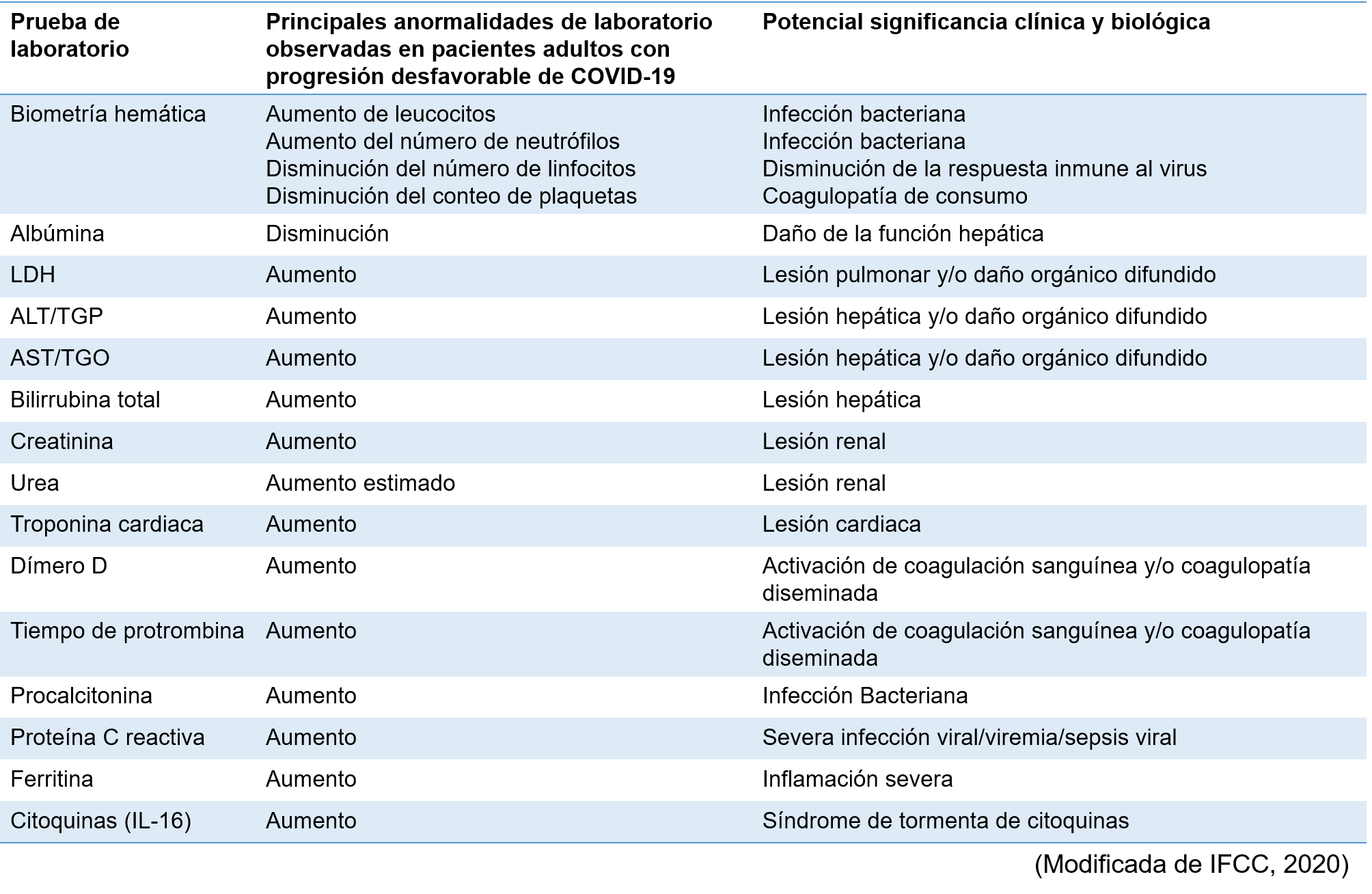
Monitoreo de los pacientes con SARS-CoV-2 por el laboratorio
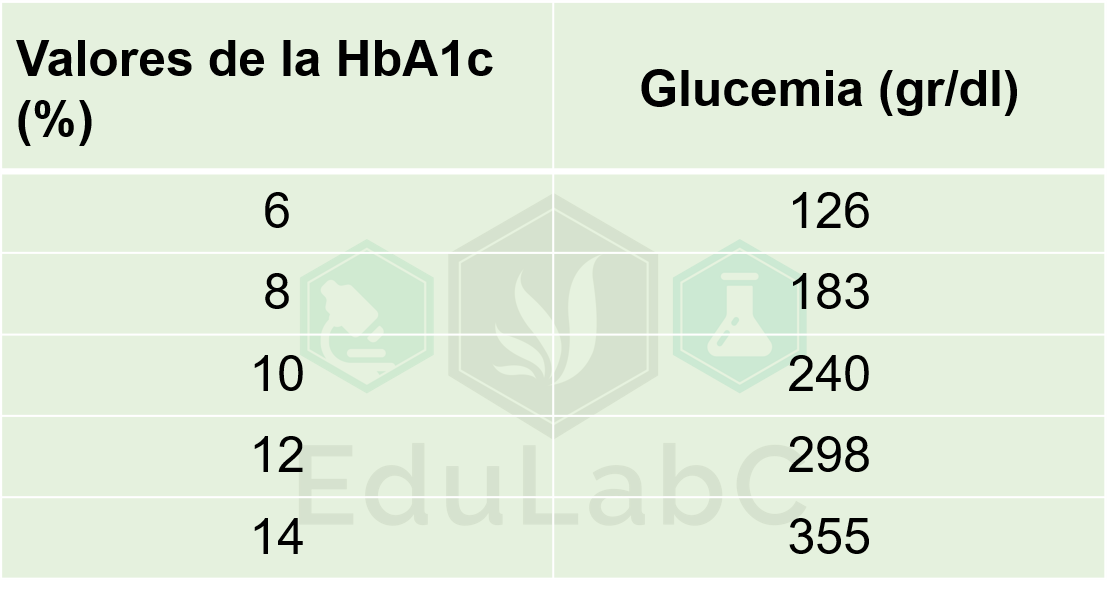
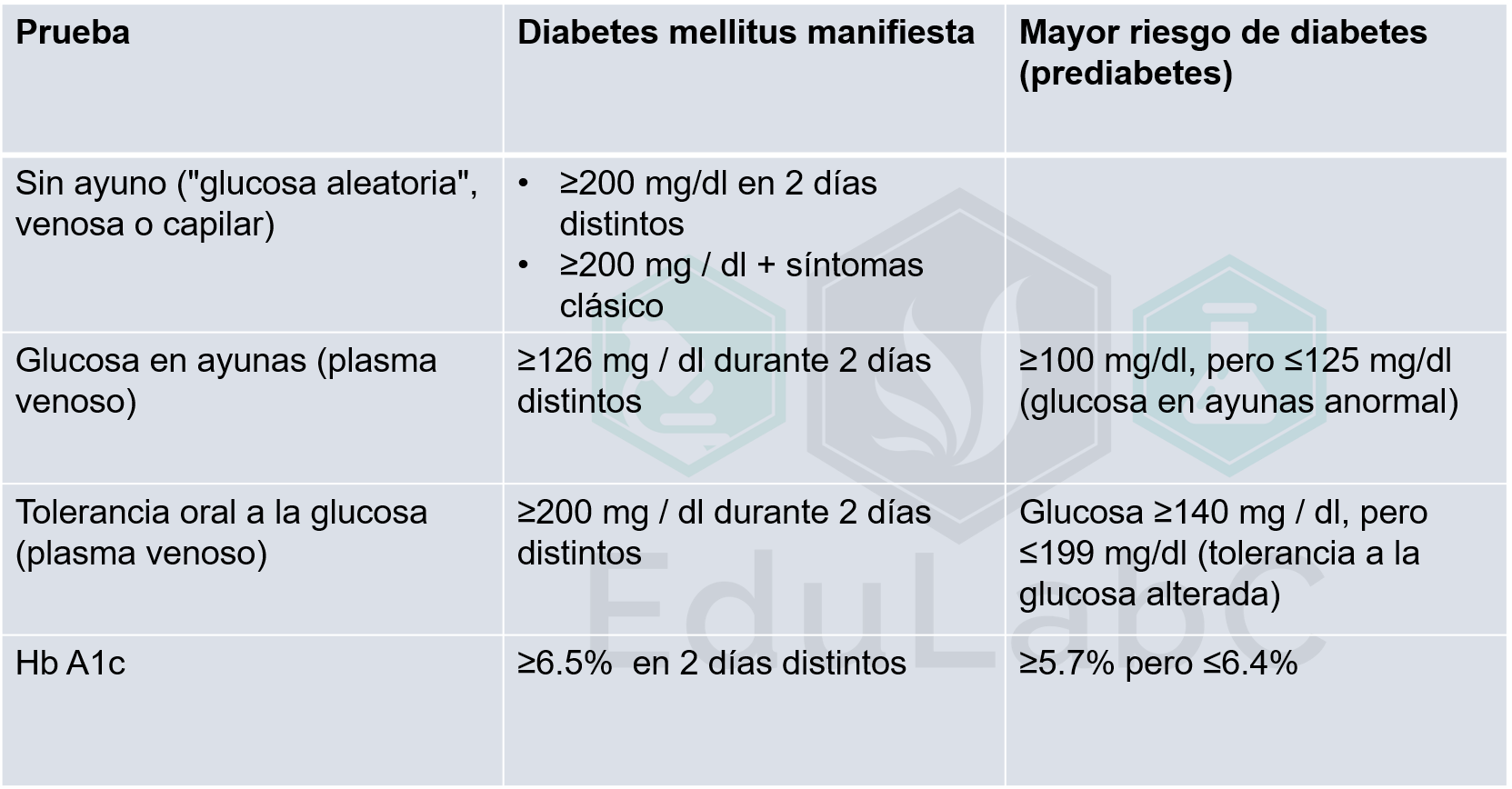
El papel esencial del laboratorio en esta pandemia va más allá del diagnóstico etiológico, el monitoreo es fundamental para evaluar la gravedad y progresión de la enfermedad. Varias pruebas de diagnostico in vitro se han relacionado a la progresión desfavorable. En la siguiente tabla se resumen las pruebas recomendadas para el monitoreo de estos pacientes según lo recomendado por la IFCC y su interpretación clínica.
Bibliografía consultada
Mahmudpour, M., Roozbeh, J., Keshavarz, M., Farrokhi, S., & Nabipour, I. (2020). COVID-19 cytokine storm: The anger of inflammation. Cytokine, 133, 155151. https://doi.org/10.1016/j.cyto.2020.155151
Sheervalilou, R., Shirvaliloo, M., Dadashzadeh, N., Shirvalilou, S., Shahraki, O., Pilehvar-Soltanahmadi, Y., Ghaznavi, H., Khoei, S., & Nazarlou, Z. (2020). COVID-19 under spotlight: A close look at the origin, transmission, diagnosis, and treatment of the 2019-nCoV disease. Journal of cellular physiology, 235(12), 8873–8924. https://doi.org/10.1002/jcp.29735
Esakandari, H., Nabi-Afjadi, M., Fakkari-Afjadi, J., Farahmandian, N., Miresmaeili, S. M., & Bahreini, E. (2020). A comprehensive review of COVID-19 characteristics. Biological procedures online, 22, 19. https://doi.org/10.1186/s12575-020-00128-2
Naserghandi, Alvand & Allameh, Seyed & Saffarpour, Reyhaneh. (2020). All about COVID-19 in brief. New Microbes and New Infections. 35. 100678. 10.1016/j.nmni.2020.100678.