Relación albúmina-creatinina
Introducción
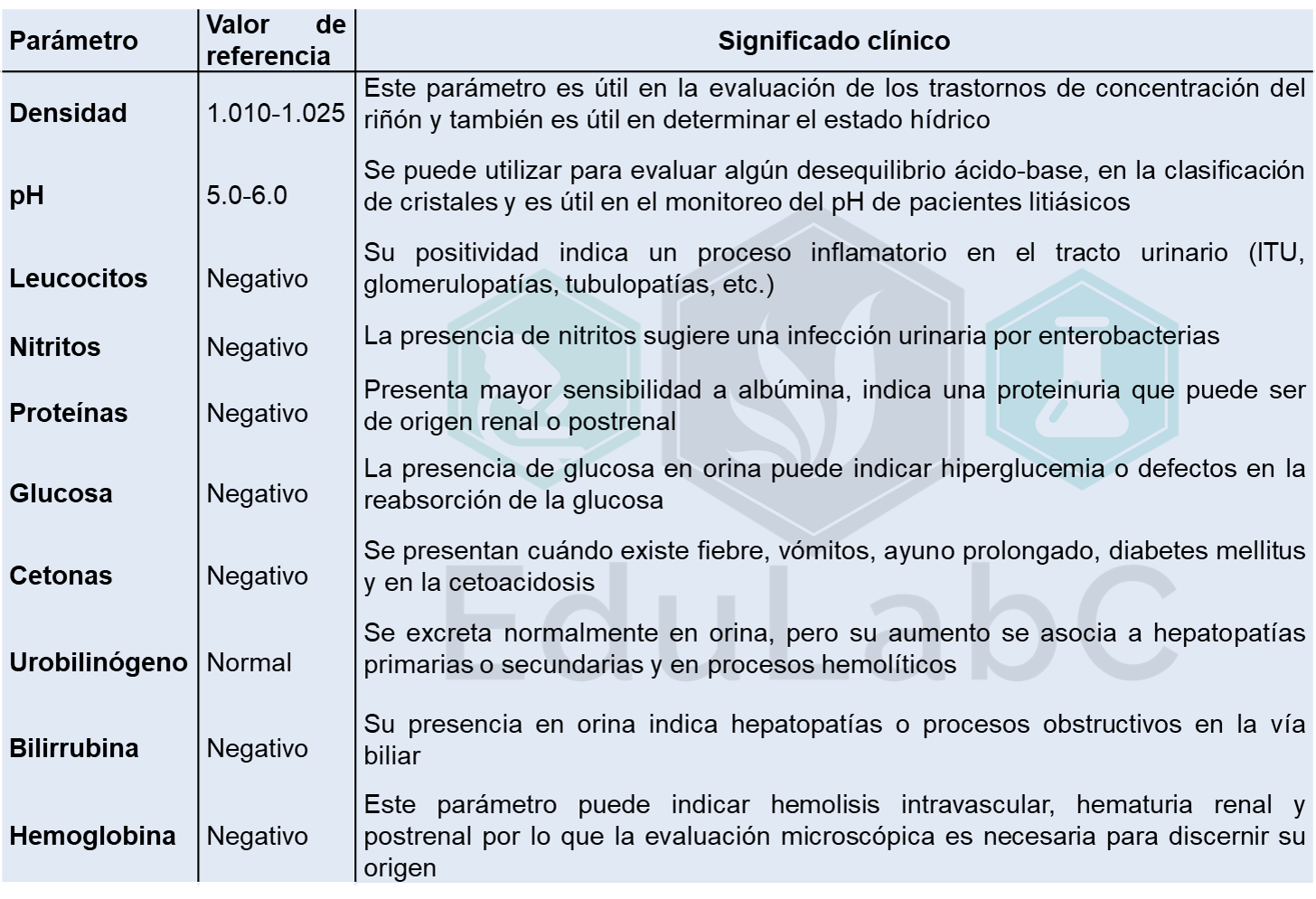
En pacientes normales se excreta aproximadamente <30 gramos/día de albúmina, en pacientes con enfermedad renal existe una disminución de la permeabilidad glomerular por lo que esta proteína es filtrada libremente. Por esta razón la evaluación de albumina es de suma importancia en el diagnóstico y seguimiento de las patologías que afectan el glomérulo ya que son un buen marcador de progresión de la enfermedad renal.
Existen varios métodos para determinar la albuminuria en pacientes con enfermedad renal, el estándar de oro se considera la determinación de albúmina o proteínas en una orina de 24 horas. Pero presenta varios inconvenientes principalmente en la recolección de la muestra, ya que es necesario guardar toda la orina de un día y preservar adecuadamente la muestra, pero en muchos establecimientos la información otorgada al paciente respecto a la toma de muestra es poco clara y conlleva a una mala recolección. Por esta razón, se ha optado por determinar la proteinuria o albuminuria en una sola muestra de orina idealmente la primera orina de la mañana, y se a demostrado en muchos estudios que se correlaciona muy bien con la determinación de 24 horas y es recomendada por muchas guías internacionales que evalúan el daño renal (KDIGO, KDOQI, NKDEP), también se ha observado que es muy sensible esta determinación en pacientes diabéticos con albuminuria de baja concentración.
Albuminuria en primera orina de la mañana
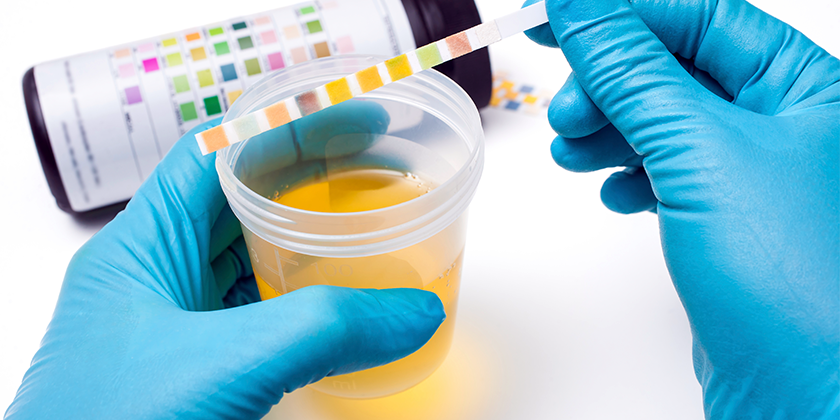
Idealmente es la primera orina de la mañana ya que orinas obtenidas al azar en el transcurso del día pueden tener variaciones respecto a la excreción de proteínas. La determinación de la albuminuria en una orina obtenida a primera hora de la mañana se debe evaluar mediante la relación albúmina-creatinina, ya que la concentración de albúmina esta sujeta a la concentración urinaria, en muestras muy diluidas puede existir una proteinuria o albuminuria, pero al estar muy diluida la cuantificación arrojara valores normales, caso contrario sucede en las orinas concentradas la determinación arrojara valores falsamente positivos si solo se cuantifica albúmina. Por esta razón es necesario normalizar la concentración de la albúmina con la tasa de filtración glomerular mediante la creatinuria.
Recomendaciones
La evaluación de la relación albúmina-creatinina se debe realizar 3 veces en un plazo no mayor a un mes para evitar sobrediagnóstico, si dos de las determinaciones muestran valores >30 mg/gr que es equivalente a una excreción de albúmina >30 mg/24 horas se considera un diagnóstico positivo de albuminuria.
La evaluación de la albuminuria se debe evitar si el paciente presenta fiebre, situaciones de estrés, realizó ejercicio intenso, presenta una ITU o se encuentra menstruando, ya que pueden ocasionar un valor falsamente positivo.
Algunas guías sobre uroanálisis recomiendan cuantificar la albumina usando la relación albúmina-creatinina en población diabética y adultos, en niños evaluar la relación proteínas-creatinina
Valores de referencia
Los valores de referencia varían, algunos autores mencionan que la prueba se considera positiva a albuminuria cuando es >30 mg/gr, pero los valores que presentan mayor consenso internacional son; Hombres >17 mg/gr y mujeres >25 mg/gr, aunque estos valores se originaron en una población diabética. Por lo que Montañés Bermúdez et al. (2011) proponen que en población no diabética el valor de referencia sea <30 mg/gr y en población diabética <17 mg/gr en hombres y <25 mg/gr en mujeres.
Microalbuminuria y macroalbuminuria.
En cuanto a la clasificación de microalbuminuria y macroalbuminuria cada guía que existe establece valores propios por lo que existe mucha confusión en el establecimiento de ambas entidades, por lo que algunos autores recomiendan no clasificarlas y hablar solamente de albuminuria.
Bibliografía consultada
Carvajal-Carvajal, C., 2017. Proteinuria y microalbuminuria. Medicina Legal de Costa Rica, 34(1).
Montañés Bermúdez, R. et al., 2011. Documento de consenso. Recomendaciones sobre la valoración de la proteinuria en el diagnóstico y seguimiento de la enfermedad renal crónica. Nefrología (Madrid), 31(3), pp.331–345..
Montero, N. et al., 2012. Correlación entre el cociente proteína/creatinica en orina esporádica y las proteínas en orina de 24 horas. Nefrologia, 32(4), pp.494–501.
Park, J.I. et al., 2017. Comparison of urine dipstick and albumin:creatinine ratio for chronic kidney disease screening: A population-based study B. O. Tayo, ed. PLOS ONE, 12(2), p.e0171106.